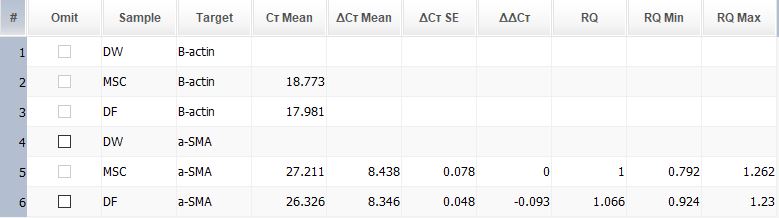
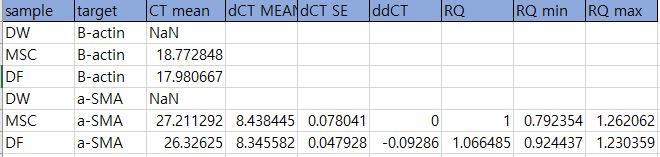
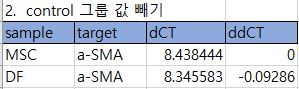
1. cDNA conc. 및 primer conc.는 datasheet를 참고해 최소로 잡아 고정하고 temp.를 조절해가며 조건을 잡는다.
※ 이 때 temp. 조건은 넓게 잡는다.
Ex) Tm값 55℃ 경우 50 53 55 또는 50 52 54 등으로 잡아 실험해본다. 1℃는 큰 차이가 나지 않는다.
2. 1. 조건으로 실험해도 적정 조건이 없는 경우에는 cDNA conc. 및 Temp.를 고정하고 primer conc.를 조절해가며 조건을 잡는다.
3. 2. 조건으로 실험해도 적정 조건이 없는 경우에는 primer conc. 및 Temp.를 고정하고 cDNA conc.를 조절해가며 조건을 잡는다.
※ 주의사항!!
모든 경우, multi peak가 뜨지 않는 조건을 사용해야 한다.
Multi peak가 뜨는 이유는 PCR condition or primer design의 문제일 수 있다.
(primer dimer일수도 있고 non-specific일수도 있다)
Condition의 문제라면 condition을 바꿔 실험하면 되고, design의 문제라면 primer를 다시 짜야 한다.
(dimer문제일 경우 primer conc.를 낮춰 사용하면 해결됨. non-specific일 경우 Tm을 올려 실험해야 함)
'protocol' 카테고리의 다른 글
| PCR 결과로 그래프 만들기 (0) | 2019.05.08 |
|---|---|
| PCR 결과로 그래프 만들기 (0) | 2019.05.08 |
| media change(부유 세포) (0) | 2018.03.07 |
| media change(부착 세포) (0) | 2018.03.07 |
| cell thawing (0) | 2018.03.07 |